LATIHAN 3
1.Perhatikan unsur di bawah ini.
-Nikel (Ni)
-Berilium (Be)
- Barium (Ba)
-Alumunium (Al)
-Kalium (K)
Berdasarkan keempat unsur di atas,yang tidak termasuk unsur logam ialah...
a.Nikel
b.Berilium
c.Barium
d.Alumunium
e.Kalium
2.Materi ialah...
a. Wujud materi yang mempunyai komposisi pasti (konstan) dan berbeda Properti
b. Gabungan dari dua atau lebih zat yang didalamnya zat tersebut mempertahankan identitas mereka yang berbeda
c. Segala sesuatu yang menempati ruang dan bermassa.
d. Suatu satuan untuk mengukur
e. Opsi a,b,c dan d salah
3.Perhatikan data berikut:
(1) Na<Cs
(2) Be>Ba
(3) N<Sb
(4) F>Br
(5) Ne>Xe
Data yang benar terdapat pada nomor...
a. (1) dan (2)
b. (2) dan (4)
c. (1) dan (5)
d. (3) dan (4)
e. (1) dan (3)
4.Unsur yang terkadang masuk ke golongan Alkali dan halogen adalah unsur...
a. Hidrogen
b. Kalium
c. Rubidium
d. Fransium
e. Kripton
KUIS 3
Chapter 1
A. hidrogen, nitrogen, dan oksigen
B. natrium, magnesium, dan alumunium
C. karbon, fosfor, dan kalium
D. nitrogen, silikon, dan raka
2.Suatu oksida nitrogen mengandung oksigen sebanyak 36,37% massa, maka rumus molekul senyawa tersebut adalah ….
A. NO
B. N2O3
C. NO3
D. N2O
E. N3O3
Chapter 2
1. Rumus kimia dari magnesium nitrida adalah...
a. Mg2N2
b. Mg2N
c.MgN2
d.Mg3N2
e. MgN
Penjelasan:
Jawabannya D. Karna dari senyawa ion biner kita tidak dapat mengetahui berapa jumlah atom penyusunnya, jadi harus dilihat dari sistem periodik.
Mg: golongan IIA, membentuk ion +2 = Mg2+
N: golongan VAmembentuk ion -3 = N3-
Untuk menentukan rumus molekul , kalian tinggal kali silang saja angkat muatan ion masing masing unsur sehingga menjadi: Mg3N2
2. Apabila ion Mg2+ bertemu dengan ion Cl- , maka terbentuk senyawa dengan rumus...
a. Mg2Cl2
b. MgCl2
c. MgCl
d. Mg3Cl3
e. Mg4Cl5
Penjelasan:
Jawabannya ialah C. Satu atom Mg (2+) dapat melepas 2 elektron, sementara satu atom Cl (-1) hanya dapat menerima 1 elektron dari luar untuk mencapai konfigurasi gas mulia (Ne= 8 elektron pada kulit terluar).
Jika atom Mg berikatan dengan atom Cl, dibutuhkan 2 atom Cl agar dapat menerima 2 elektron dari Mg.
Chapter 3
1. 1. Hitunglah nilai yang terkadandung dalam massa molekul relatif (Mr) dari senyawa Aluminium Sulfat Al2(SO4)3 (Ar Al = 27, Ar S = 32, Ar O = 16 ) ?
a. a. 287
b. b. 323
c. c. 184
d. d. 245
e. e. 342
Pembahasan
Jawabannya adalah E
Dari 1 molekul Al2(SO4)3 mengandung :
- 2 atom Al
- 3 atom S
- 12 atom O
Dengan demikian kita dapat mencari Mr Al2(SO4)3 dengan menjumlahkan masing-masing Ar atom tersebut :
Mr Al2(SO4)3 = (2 x Ar Al) + (3 x Ar S) + (12 x Ar O)
Mr Al2(SO4)3 = (2 x 27) + (3 x 32) + (12 x 16)
Mr Al2(SO4)3 = 54 + 96 + 192
Mr Al2(SO4)3 = 342
2. Hitunglah Mr dari CuSO4.5H2O (Ar Cu = 64, Ar S = 32, Ar O = 16, Ar H = 1)
a.250
b.144
c.167
d.234
e.325
Pembahasan
Dari 1 molekul CuSO4 . 5H2O mengandung :
- 1 atom Cu
- 1 atom S
- 9 atom O
- 10 atom H
Dengan demikian kita dapat mencari Mr CuSO4 . 5H2O dengan menjumlahkan masing-masing Ar atom tersebut :
Mr CuSO4 . 5H2O = (1 x Ar Cu) + (1 x Ar S) + (9 x Ar O) + (10 x Ar H)
Mr CuSO4 . 5H2O = (1 x 64) + (1 x 32) + (9 x 16) + (10 x 1)
Mr CuSO4 . 5H2O = 64 + 32 + 144 + 10
Mr CuSO4 . 5H2O = 250
Chapter 4
1. Tentukan bilangan oksidasi S dalam SO3!
a.4
b.5
c.2
d.6
e.4
Jawab:
Jumlah bilangan oksidasi SO3 = 0
Jumlah bilangan oksidasi O = -2
Maka:
⇒ b.o S + (3 × b.o O) = 0
⇒ b.o S + (3 × -2) = 0
⇒ b.o S + (-6) = 0
⇒ b.o S = 0 + 6
⇒ b.o S = 6
Jadi, bilangan oksidasi S dalam SO3 adalah 6.
2. Tentukan biloks F dalam FeO!
a.1
b.2
c.3
d.4
e.5
Jawab:
Jumlah bilangan oksidasi FeO = 0
Jumlah bilangan oksidasi O = -2
Maka:
⇒ b.o F + (1 × b.o O) = 0
⇒ b.o F + (1 × -2) = 0
⇒ b.o F + (-2) = 0
⇒ b.o F = 0 + 2
⇒ b.o F = 2
Jadi, bilangan oksidasi F adalam FeO adalah 2.
Chapter 6
1. Perubahan entalpi dari reaksi manakah yang berikut ini dapat disebut dengan perubahan entalpi pembentukan ΔHf° Na2SO4 kristal….
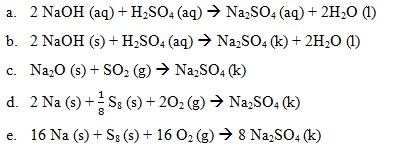
Pembahasan:
Perubahan entalpi pembentukan standar merupakan perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil pada keadaan stabil, pada 25°C dan tekanan 1 atm. Perubahan entalpi pembentukan standar suatu zat ditentukan dengan menggunakan rumus:
ΔHfo reaksi = ∑ ΔHf° hasil – ∑ΔHf° pereaksi
Reaksi pembentukan ΔHf° Na2SO4
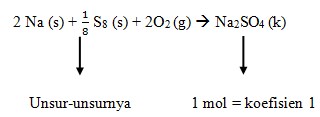
2. Diantara persamaan termokimia di bawah ini yang merupakan perubahan entalpi penguraian adalah…
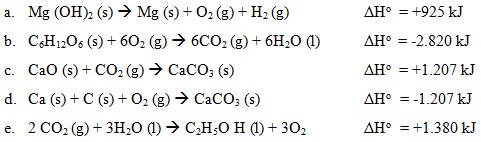
Pembahasan:
Jawabannya adalah A
Perubahan entalpi penguraian standar adalah perubahan entalpi yang terjadi pada penguraian 1 mol suatu senyawa menjadi unsur-unsurnya yang paling stabil pada keadaan standar.
Pada dasarnya, perubahan entalpi penguraian standar merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya pun akan berlawanan tandanya.
Chapter 7
1. Bilangan kuantum magnetik (m) = -3 dimiliki oleh elktron dari atom yang memiliki kulit elektron minimal sebanyak. . . .
A. 2
B. 3
C. 4
D. 5
D. 6
Pembahasan :
Jawabannya adalah C
Jika memiliki m = -3, artinya nilai bilangan kuantum azimuth elektron dalam atom itu minimal adalah 3 karena nilai m itu bergantung pada harga l ( jika l = 3, maka harga m -nya = -3, -2, -1, 0, +1, +2, +3).
Untuk l = 3, maka minimal sebuah atom harus memiliki harga bilangan kuantum utama (n) adalah 4 karena nilai l itu dimulai dari 0, 1, ......sampai (n-1). Jadi jika n = 4, maka harga l = 0, 1, 2, 3.
bilangan kuantum utama menyatakan kulit atom. n = 4 artinya elektron berada pada tingkat energi ke empat atau kulit keempat (kulit N). Jadi agar suatu elektron memiliki nilai bilangan kuantum magnetik (m ) = - 3, maka atom itu harus memiliki setidaknya 4 buah kulit atom.
2. Jika suatu elektron mempunyai bilangan kuantum utama , n = 2, kemungkinan bilangan kuantumlainnya adalah . . . .
A. l = 1, m = 0, s = +1/2
B. l = 1, m = 2, s = -1/2
C. l = 2, m = -2, s = +1/2
D. l = 2, m = 2, s = -1/2
E. l = 2, m = 0, s = +1/2
Pembahasan :
Jawabannya adalah A
Jika n = 2, maka
Harga l = 0, 1
Untuk l = 0 m = 0
Untuk l = 1 m = -1, 0, +1
Harga s yang mungkin tentunya hanya dua yaitu +1/2 dan -1/2
Ada beberapa kemungkinan jawaban untuk bilangan kuantum lainnya
n = 2, l = 0, m = 0 , s = +1/2 atau -1/2
n = 2, l =1, m = -1, 0, +1, s = +1/2 atau -1/2
Chapter 9
1. Setiap unsur mampu membentuk ikatan kimia karena memiliki ….
a. Elekcron valensi
b. Kecendrungan membentuk konfigurasi electron gas mulia
c. Lintasan electron
d. Neutron dalam inti atom
e. Proton dan neutron
Pembahasan:
Unsur-unsur gas mulia sukar bereaksi karena unsur-unsur tersebut tergolong unsur yang stabil. Menurut G. N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh electron valensinya yang berjumah delapan, keculi He yang hanya memiliki dua electron.
Setiap atom dalam pembentukan senyawa membentuk konfigurasi electron yang stabil, yaitu :
- Konfigurasi electron gas mulia yang disebut konfigurasi octet atau kaidah oktet,
- Sedangkan Helium disebut kaidah duplet.
Atom-atom suatu unsur berusaha mencapai konfigurasi octet atau duplet dengan cara berikatan dengan atom-atom lain.
Ikatan yang terjadi dapat berupa ikatan ion, kovalen dan kovalen koordinasi.
2. Diantara sifat berikut ini yang bukan sifat senyawa ion adalah …
a. Rapuh
b. Titik leleh tinggi
c. Larutan dapat menghantar listrik
d. Lelehannya dapat menghantar listrik
e. Padatannya dapat menghantar listrik
Pembahasan:
Sifat senyawa ion, yaitu:
- Kristalnya keras tetapi rapuh
- Mempunyai titik lebur dan titik didih yang tinggi
- Mudah larut di dalam air
- Dapat menghantar arus listrik dalam keadaaan cair dan larutan, tetapi dalam padatan tidak bisa.
Chapter 10
1.kenyawa kovalen berikut yang bersifat non polar adalah . . .
a. NH3, N2, O2
b. H2O, HCl, HF
c. PCl3, PCl5, ClO3
d. H2, Br2, CH4
e. HBr, HCl, HI
Pembahasan :
Ikatan kovalen non polar:
- Larut dalam pelarut non polar
- Bentuk murni maupun larutannya tidak dapat menghantarkan listrik
- Ciri-ciri:
- Homoatomik (Br2, N2, O2, O3, H2)
- Dispersi nergy simetris (CH4, CO2, PCl5)
- Momen dipol = 0
2. Titik didih air lebih rendah dibandingkan titik didih intan, hal tersebut disebabkan . . .
a. Ikatan kovalen yang terbentuk pada intan sangat lemah
b. Pada saat dipanaskan, nergy yang diperlukan untuk memutuskan ikatan kovalen pada intan sangat besar
c. Ikatan antarmolekul pada air menyebabkan pergerakan partikel-partikel lebih bebas
d. Pada saat air dipanaskan, ikatan yang terputus adalah ikatan antara atom H dan O, bukan ikatan antarmolekul air
e. Ikatan antar-atom pada air menyebabkan pergerakan partikel-partikel lebih bebas
Pembahasan:
ikatan kovalen yang terbentuk pada grafit, intan, dan nergy sangat kuat. Jadi, pada saat dipanaskan, nergy yang diperlukan untuk memutuskan ikatan sangat besar. Faktor inilah yang menyebabkan titik didih dan titik lelehnya sangat besar.
Chapter 11
- AsH3
- BCl3
- Cl2
- CO2
- XeF4
Molekul-molekul akan memiliki gaya dipol-dipol bila molekul tersebut bersifat polar.
Setiap atom kebanyakan akan stabil bila elektron valensinya berjumlah 8 atau 2. Untuk senyawa kovalen bisa dicapai dengan menggunakan pasangan elektron bersama atom-atom lain.
AsH3:
As atom pusat (jumlahnya hanya 1 atom).
As mempunyai e-valensi 5
H atom luar dengan e-valensi 1
H merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
H berjumlah 3 atom → X3
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 5 – (3 × 1) = 5 – 3 = 2
PEB = jumlah EB/2 = 2/2 = 1 → E1
Keterangan EB = elektron bebas, PEB = pasangan elektron bebas
AsH3→ sistem AX3E1 atau AX3E
AX3E → Bentuk molekul piramida segitga → polar
BCl3:
B atom pusat (jumlahnya hanya 1 atom).
B mempunyai e-valensi 3
Cl atom luar dengan e-valensi 7
Cl merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
Cl berjumlah 3 atom → X3
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 3 – (3 × 1) = 3 – 3 = 0
PEB = 0 → E0
BCl3→ sistem AX3E0 atau AX3
AX3→ Bentuk molekul segitiga datar → nonpolar
CO2:
C atom pusat (jumlahnya hanya 1 atom).
C mempunyai e-valensi 4
O atom luar dengan e-valensi 6
O merupakan atom divalen (perlu 2 elektron lagi untuk stabil)
O berjumlah 2 atom → X2
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 4 – (2 × 2) = 4 – 4 = 0
PEB = 0 → E0
CO2→ sistem AX4E0 atau AX4
AX4→ Bentuk molekul tetrahedral → nonpolar
Cl2:
Cl2 atau Cl – Cl → molekul diatomik → nonpolar.
XeF4:
Xe atom pusat (jumlahnya hanya 1 atom).
Xe mempunyai e-valensi 8
F atom luar dengan e-valensi 7
F merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
F berjumlah 4 atom → X4
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 8 – (4 × 1) = 8 – 4 = 4
PEB = jumlah EB/2 = 4/2 = 2 → E2
XeF4→ sistem AX3E2
AX3E2 → Bentuk molekul segiempat datar → nonpolar
Kesimpulan, dari pilihan molekul yang tersedia hanya AsH3 yang bersifat polar. Jadi yang memiliki gaya tarik menarik adalah AsH3 saja. Molekul lain semua bersifat nonpolar, tidak punya gaya dipol-dipol
- CH4
- HCl
- NH3
- C6H13NH2
- NaCl
Pembahasan Soal #2:
Gaya dispersi hanya dimiliki oleh molekul-molekul nonpolar dan atom golongan gas mulia.
Bila sudah terbiasa maka dengan cepat dapat ditentukan.
CH4
C atom pusat (jumlahnya hanya 1 atom).
C mempunyai e-valensi 4
H atom luar dengan e-valensi 1
H merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
H berjumlah 4 atom → X4
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 4 – (4 × 1) = 4 – 4 = 0
PEB = 0 → E0
CH4 → sistem AX4E0→ AX4E0 → bentuk molekul tetrahedral → nonpolar
HCl → molekul polar, molekul diatomik tetapi beda nilai keelektronegatifannya sehingga akan terjadi pengkutuban atau dipol, elektron tertarik ke atom yang memiliki keelektronegatifan lebih besar. Cl lebih elektronegatif dibanding H.
NH3→ Sama dengan AsH3 bahasan soal nomor 1, sebab N segolongan dengan As. NH3 bersifat polar.
C6H13NH2→ molekul polar, seperti pada NH3 memiliki 1 PEB pada N, berbentuk piramida segitiga, bentuk tidak simetri, C6H13 ini adalah pengganti 1 atom H pada NH3 .
NaCl → senyawa ionik, jelas tidak bersifat nonpolar.
CH3Cl → bentuk molekulnya seperti CH4, 1 atom H diganti atom Cl. Karena Cl memiliki keelektronegatifan berbeda dengan H maka sifat molekulnya polar.
H2S →
S atom pusat (jumlahnya hanya 1 atom).
S mempunyai e-valensi 6
H atom luar dengan e-valensi 1
H merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
H berjumlah 2 atom → X2
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 6 – (2 × 1) = 6 – 2 = 4
PEB = jumlah EB/2 = 4/2 = 2 → E2
H2S → sistem AX2E2→ bentuk molekul bengkok → polar
Kr → atom golongan gas mulia → nonpolar.
Kesimpulan, dari pilihan molekul yang tersedia yang bersifat nonpolar adalah CH4 dan Kr. Jadi yang memiliki gaya dispersi adalah CH4 dan Kr
1. Dalam hukum henry, pada larutan yang encer dan tekanan konstan konsentrasi zat terlarut sebanding dengan.....dalam kesetimbangan
A. Tekanan Parsial Gas
B. Temperatur
C.Tekanan
D. Energi dalam
E. Larutan Tertentu
2. Dispersi zat cair atau zat padat dalam gas disebut
A. Sol
B. Emulsi
C. Buih
D. Aerosol
E. Suspensi


No comments:
Post a Comment