Latihan 8
1.Lapisan
atmosfer yang merupakan lapisan udara terionisasi adalah:
A.
Ionosfer
B.
Stratosfer
C.
Ekosfer
D.
Ozonsfer
E.
Termosfer
2.Lapisan ionosfer memiliki peranan sangat penting, yaitu:
A. Penyerap utama radiasi
ultraviolet
B. Memantulkan gelombang radio
yang dipancarkan dan menahan sebagian radiasi matahari
C. Melepas molekul bebas keluar
bumi
D. Memantulkan gelombang suara
dan menyebarkan radiasi matahari
E. Meneruskan gelombang suara
dan menahan radiasi matahari
3.Di bawah ini, pengertian dari turbulensi adalah:
A. Pemanasan sinar matahari
secara vertikal
B. Penyebaran panas secara
horizontal
C. Pemanasan berdasarkan kontak
atau secara bersinggungan
D. Penyebaran panas secara
berputar-putar
E. Pelepasan panas di daerah
pegunungan
4.Perhatikan
data mengenai hujan berikut:
- Terjadi di daerah pegunungan
- Proses kondensasi yang disebabkan
ketinggian lereng gunung
Kedua
data tersebut termasuk ke dalam proses terjadinya hujan:
A.
Frontal
B.
Siklon
C. Orografis
D.
Zenital
E.
Tidak ada jawaban yang benar
KUIS 8
chapter 13
1. Data percobaan dari reaksi : NH4+ (aq) + NO (aq) N2 (aq) + 2H2O (l)
Tentukan rumus kecepatan reaksi berdasarkan percobaan diatas!
Penyelesaian :
Gambar 2
Maka :
Rumus kecepatan reaksinya adalah = r = k[NO2-][NH4+]2
2. Dari reaksi : 2NO (g) + 2H2 (g) N2 (g) + 2H2O (g) Diperoleh data sebagai berikut :
Gambar3
a. Tentukan Orde reaksi dari data di atas!
b. Tentukan persamaan laju reaksi tersebut!
Penyelesaian :
a. Gambar4
Reaksi terhadap NO orde = 1
Reaksi terhadap H2 orde = 1
Orde reaksi = 1 + 1 = 2
b. Menentukan pangkat reaksi NO, dengan laju reaksi untuk H2 tetap.
Menentukan pangkat reaksi H2, laju reaksi untuk [NO] tetap
Jadi persamaan laju reaksinya adalah : V = k [NO] [H2]
1. Tetapan kesetimbangan dari reaksi SnO2 + 2H2(g) ⇔ Sn(s) + 2H2O(l) adalah ….
a. Kc = [H2O]2/[H2]2
b. Kc = [Sn][H2O]2/[Sn][H2]2
c. Kc = [Sn]/[SnO2]
d. Kc = [2H2O]/[2H2]
e. Kc = [H2O]2/[SnO2] [H2]2
alasan :
misal aA + bB <-> cC + dD
kc= (C)c (D)d / (A)a (B)b
1. Derajat keasaman dari larutan 100 ml H2SO4 0,02 M adalah . . . .
a. 2 – log 4
b. 2 + log 4
c. 2 + log 2
d. 12 + log 4
e. 12
Pembahasan:
H2SO4 merupakan asam kuat, bervalensi 2
[H+] = Ma x Val
= 0,02 x 2 = 4 x 10-2
pH = -log 4 X 10-2
= 2-log 4
Jawaban: A
2. Berapakah konsentrasi ion [OH–] dalam larutan jika konsentrasi H+ = 2 X 10-4 M (Diketahui Kw = 10-14)…….
a. 5 X 10-10
b. 5 X 10-18
c. 0,2 X 10-10
d. 0,2 X 10-8
e. 2 X 10-10
Pembahasan:
Dalam larutan dengan pelarut air, berlaku :
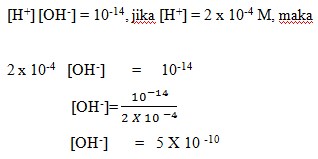
Jawaban: A
8. Larutan asam lemah NH4OH 0,1 M,dan Kb = 10-5 , nilai pH larutan tersebut adalah… . .
a. 11
b. 3
c. 9
d. 14
e. 6
1. Larutan CH3COOH 0,1 M terionisasi dengan derajat ionisasi α= 0,01 mempunyai pH sebesar…..
a. 1
b. 2
c. 3
d. 4
e. 5
Penyelesaian :
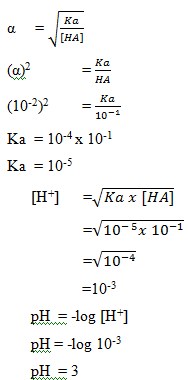
Jawaban : C
2. Terdapat 100 mL larutan NH4OH 0,1 M, Kb NH4OH = 10-5. Maka konsentrasi ion OH– adalah…..
a. 10-3 M
b. 10-1 M
c. 10-2 M
d. 10-6 M
e. 10-5 M
Penyelesaian :
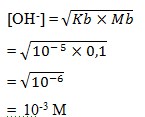
Jawaban : A
2. Sebuah mesin pesawat mengambil 9200 J panas dan membuang 6000 J setiap siklus. a) Berapa kerja mekanik keluaran dari mesin setiap siklus? b) Berapa efisiensi termal dari mesin?
1. Bila diketahui potensial elektrode standar dari :
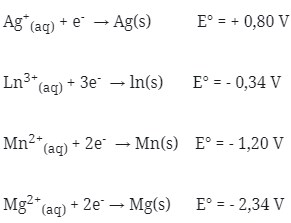
Pasangan sel volta yang akan menghasilkan potensial sel sebesar 0,86 V adalah …
a. ln|ln3+||3Ag+|3Ag
b. Mg|Mg2+||Mn2+|Mn
c. Mn|Mn2+||2Ag+|Ag
d. 2ln|2ln3+||3Mn2+|3Mn
e. 3Mn|3Mn2+||2ln3+|2ln
Jawaban : E
Pembahasan :
Dicari satu persatu potensial sel dari pilihan jawaban
(a) E°sel = E°katode – E°anode
= +0,80 – (- 0,34 ) = 1,14 V
(b) E°sel = E°katode – E°anode
= -1,20 – (-2,34) = 1,14 V
(c) E°sel = E°katode – E°anode
= + 0,80 – (-1,20) = 2 V
(d) E°sel = E°katode – E°anode
= – 1,20 – (- 0,34) = – 0,86 V
(e) E°sel = E°katode – E°anode
= – 0,34 – (- 1,20) = 0,86 V
Jadi, jawaban yang benar adalah E
2. Diketahui :
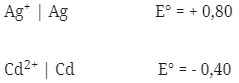
Potensial sel yang dihasilkan dari pasangan elektrode Cd dengan Ag adalah …
a. 0,40 V
b. 0,44 V
c. 0,76 V
d. 0,80 V
e. 1,20 V
Jawaban : E
Pembahasan :
Logam yang memiliki E° lebih kecil selalu merupakan anode (mengalami oksidasi) berarti yang sebagai anode Cd dan sebagai katode Ag.
Notasi Selnya :
Cd|Cd2+||Ag+|Ag
E°sel = E°katode – E°anode
= + 0,80 – (-0,40)
= 1,20 V








No comments:
Post a Comment